Unter Metallkorrosion versteht man die Zersetzung von Werkstoffen durch die Reaktion zwischen Metall und seiner Umgebung. Es handelt sich um einen elektrochemischen Prozess, bei dem jede Bedingung, die den Elektronenfluss begünstigt, die Korrosion beschleunigt.
1. die Arten der Metallkorrosion
Abhängig von der Korrosionsumgebung und der Metallart kann Korrosion in drei Formen unterteilt werden: Verfärbung, Korrosion und Rost.
- Verfärbung
Verfärbung ist eine milde Form der Oberflächenkorrosion, die zu Farbveränderungen oder Glanzverlusten führt. Sie beeinträchtigt im Allgemeinen nicht die strukturelle Integrität des Metalls, sondern nur sein Aussehen. Metalle wie Kupfer und Silber können sich in Umgebungen mit Sauerstoff, Schwefel oder Halogenen verfärben und Oxide oder Sulfide bilden, insbesondere unter feuchten Bedingungen.
- Korrosion
Bei der Korrosion kommt es zu größeren Schäden und Veränderungen der metallurgischen Eigenschaften. Wenn zum Beispiel Aluminium oder Zink korrodieren, bildet sich ein weißes Pulver, und Kupfer bildet eine grüne Schicht.
- Rost
Rost ist die Korrosion von Eisenmetallen wie Eisen, die zur Bildung von Eisenoxiden führt und die häufigste Art der Korrosion ist.
2. der Mechanismus der allgemeinen Metallkorrosion
Das Wesen der Korrosion ist der Austausch von Elektronen zwischen der Metalloberfläche und ihrer Umgebung. Bei diesem Prozess wird das Metall oxidiert, was zu elektrochemischen Reaktionen führt. Bei der Korrosion von Eisen mit Wassertröpfchen beispielsweise bildet sich eine Konzentrationszelle, die Korrosion verursacht. Der Sauerstoffgehalt in der Mitte des Wassertropfens ist geringer als an den Rändern, so dass ein Anoden- und ein Kathodenbereich entstehen, was zur Bildung von Rost führt.
Mechanismus der Rostbildung auf Eisenoberflächen
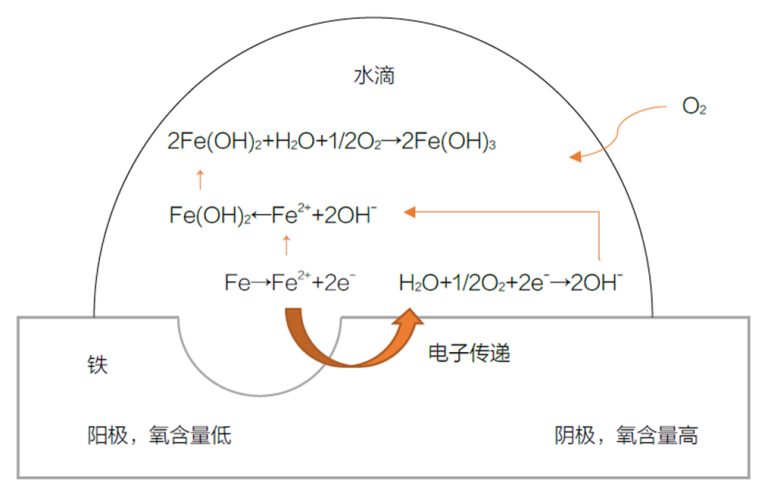
- Der sauerstoffarme Bereich fungiert als Anode, in der Eisenatome Elektronen verlieren und zu Eisenionen werden: Fe → Fe²⁺ + 2e-
- Am Rande des Wassertropfens reduzieren das Wasser und die freigesetzten Elektronen den Sauerstoff und bilden Hydroxidionen (Kathodenbereich): ½ O₂ + H₂O + 2e- → 2OH-
- Die Hydroxid-Ionen verbinden sich mit den Eisen-Ionen zu Eisenhydroxid: Fe²⁺ + 2OH- → Fe(OH)₂
- Eisenhydroxid reagiert weiter mit Wasser und Sauerstoff und bildet braunen Rost: 2Fe(OH)₂ + H₂O + ½ O₂ → 2Fe(OH)₃
3) Arten von Korrosion
3.1 Gleichmäßige Korrosion
Wenn Wasser oder andere Flüssigkeiten eine Metalloberfläche vollständig bedecken, verschieben sich die Anoden- und Kathodenbereiche kontinuierlich, was zu einer gleichmäßigen Korrosion führt. Dies ist die häufigste Form der alltäglichen Metallkorrosion.
3.2 Elektrolyteffekte
Reines Wasser hat aufgrund seiner geringen Ionisierungskapazität ein geringes Korrosionspotenzial. Durch die Zugabe von Säuren, Basen oder Salzen erhöht sich jedoch die Ionenkonzentration, was die Korrosion beschleunigt. In einigen Fällen reagieren die Elektrolyte mit der Metalloberfläche und bilden einen Passivierungsfilm, der den Korrosionsprozess verlangsamt.
3.3 Korrosion durch Sauerstoffkonzentration
Wie bereits beschrieben, fungiert der Bereich mit niedrigem Sauerstoffgehalt als Anode und der Bereich mit hohem Sauerstoffgehalt als Kathode, was zur Korrosion der Sauerstoffkonzentrationszelle führt.
3.4 Galvanische Korrosion
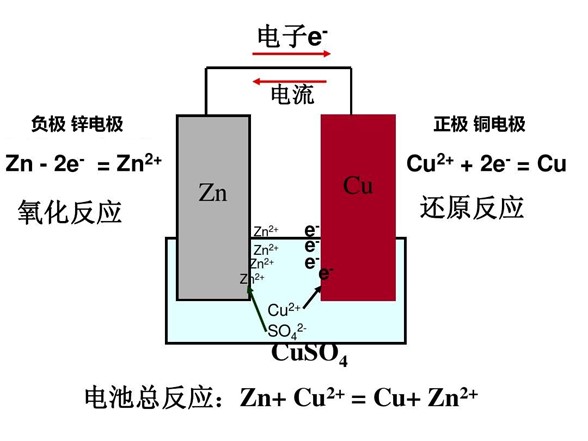
Wenn verschiedene Metalle in dieselbe Flüssigkeit getaucht werden, kommt es zu einer elektrochemischen Reaktion, die galvanische Korrosion verursacht. Dies ist das Prinzip von Batterien.
Das Prinzip der Batterie
3.5 Erosion Korrosion
Erosionskorrosion tritt auf, wenn schnell fließende Flüssigkeiten die Metalloberfläche mechanisch abtragen. Dies ist besonders wichtig bei Rohrleitungen und Pumpensystemen.
3.6 Fretting-Korrosion
Ähnlich wie Erosion tritt Passungsrost auf, wenn feste Materialien Schutzschichten von Metalloberflächen abtragen, was häufig an Kontaktstellen zwischen Teilen der Fall ist.
3.7 Lochfraßkorrosion
Lochfraßkorrosion tritt auf, wenn kleine Bereiche einer Metalloberfläche örtlich begrenzt korrodieren. Wenn zum Beispiel eine schützende Oxidschicht zerkratzt wird, wird der freiliegende Bereich zur Anode, was zu einer Korrosionsgrube führt.
3.8 Interkristalline Korrosion
Interkristalline Korrosion ist eine Art von örtlich begrenzter Korrosion, die sich entlang der Korngrenzen von Metallen ausbreitet. Sie tritt bei rostfreiem Stahl auf, wenn er auf bestimmte Temperaturen erhitzt wird. Dabei entstehen an den Korngrenzen chromarme Zonen, die zu einem Verlust der Korrosionsbeständigkeit führen.
3.9 Spannungsrisskorrosion
Spannungskorrosion tritt unter Zugspannung auf, insbesondere bei geschweißten Werkstücken mit Eigenspannung. Der Schutzfilm auf der Metalloberfläche wird beschädigt, was zu Rissen führt, die sich mit der Zeit ausbreiten und zu Brüchen führen.
3.10 Mikrobiell induzierte Korrosion
Mikroorganismen, wie aerobe und anaerobe Bakterien, in Metallbearbeitungsflüssigkeiten auf Wasserbasis können mikrobiell bedingte Korrosion verursachen. Aerobe Bakterien bauen langkettige Moleküle in Schmierstoffen ab und bilden Säuren, die Korrosion verursachen, während anaerobe Bakterien Schwefelverbindungen produzieren, die zu Verfärbungen führen.
Bakterielle Atmung

4. korrosionsverhindernde Gegenmaßnahmen
- Passivierungsmittel
Metalle können zur Passivierung eine natürliche Oxidschicht bilden, oder es können bestimmte Salze verwendet werden, um einen Schutzfilm auf der Metalloberfläche zu erzeugen. Eisen kann zum Beispiel durch Eintauchen in Nitrite, Chromate oder Molybdate passiviert werden.
- Organische Filme
Organische Filme, wie z. B. Beschichtungen auf Ölbasis, können auf Metalloberflächen aufgebracht werden und bilden eine Barriere zwischen dem Metall und seiner Umgebung. Diese Methode bietet jedoch nur einen vorübergehenden Schutz.
- Bakterielle Inhibitoren
Wenn die Korrosion durch Bakterien verursacht wird, können Bakterizide eingesetzt werden, um aerobe Bakterien zu hemmen, während Sauerstoff hinzugefügt werden kann, um anaerobe Bakterien zu bekämpfen. Ist die mikrobielle Korrosion bereits weit fortgeschritten, muss die Arbeitsflüssigkeit möglicherweise ausgetauscht werden, um weitere Schäden zu verhindern.

