La corrosione dei metalli si riferisce al degrado dei materiali causato dalla reazione tra il metallo e il suo ambiente. Si tratta di un processo elettrochimico, in cui qualsiasi condizione che faciliti il flusso di elettroni accelera la corrosione.
1.Tipi di corrosione dei metalli
A seconda dell'ambiente di corrosione e del tipo di metallo, la corrosione può essere classificata in tre forme: decolorazione, corrosione e ruggine.
- Decolorazione
La decolorazione è una forma lieve di corrosione superficiale che comporta cambiamenti di colore o perdita di lucentezza. In genere non influisce sull'integrità strutturale del metallo, ma solo sul suo aspetto. Metalli come il rame e l'argento possono scolorire in ambienti con ossigeno, zolfo o alogeni, formando ossidi o solfuri, soprattutto in condizioni di umidità.
- Corrosione
La corrosione comporta danni più estesi e cambiamenti nelle proprietà metallurgiche. Ad esempio, quando l'alluminio o lo zinco si corrodono, formano una polvere bianca, mentre il rame forma uno strato verde.
- Ruggine
La ruggine è la corrosione di metalli ferrosi come il ferro, con conseguente formazione di ossidi di ferro, che è il tipo di corrosione più comune.
2.Meccanismo della corrosione dei metalli comuni
L'essenza della corrosione è lo scambio di elettroni tra la superficie del metallo e il suo ambiente. In questo processo, il metallo viene ossidato, dando luogo a reazioni elettrochimiche. Ad esempio, nella corrosione del ferro con gocce d'acqua, si forma una cella di concentrazione che provoca la corrosione. Il contenuto di ossigeno al centro della goccia d'acqua è inferiore a quello dei bordi, creando una regione anodica e una catodica che porta alla formazione di ruggine.
Meccanismo di formazione della ruggine sulla superficie del ferro
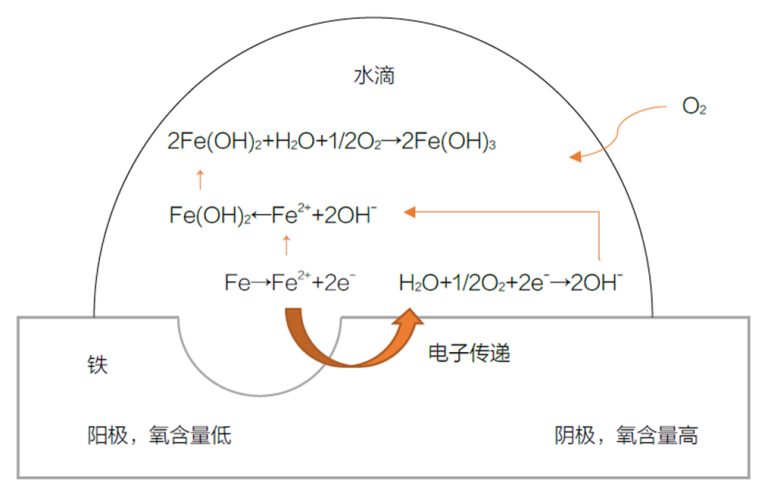
- La regione a basso contenuto di ossigeno funge da anodo, dove gli atomi di ferro perdono elettroni e diventano ioni di ferro: Fe → Fe²⁺ + 2e-
- Sul bordo della goccia d'acqua, l'acqua e gli elettroni liberati riducono l'ossigeno, formando ioni idrossido (regione catodica): ½ O₂ + H₂O + 2e- → 2OH-
- Gli ioni idrossido si combinano con gli ioni ferro per formare l'idrossido ferroso: Fe²⁺ + 2OH- → Fe(OH)₂
- L'idrossido ferroso reagisce ulteriormente con acqua e ossigeno, formando ruggine marrone: 2Fe(OH)₂ + H₂O + ½ O₂ → 2Fe(OH)₃
3.Tipi di corrosione
3.1 Corrosione uniforme
Quando l'acqua o altri liquidi ricoprono completamente una superficie metallica, le regioni anodiche e catodiche si spostano continuamente, provocando una corrosione uniforme. Questa è la forma più comune di corrosione quotidiana dei metalli.
3.2 Effetti elettrolitici
L'acqua pura ha un basso potenziale di corrosione grazie alla sua bassa capacità di ionizzazione. Tuttavia, l'aggiunta di acidi, basi o sali aumenta la concentrazione di ioni, accelerando la corrosione. In alcuni casi, gli elettroliti reagiscono con la superficie del metallo formando una pellicola di passivazione che rallenta il processo di corrosione.
3.3 Corrosione da concentrazione di ossigeno
Come descritto in precedenza, la regione a basso contenuto di ossigeno funge da anodo e quella ad alto contenuto di ossigeno da catodo, causando la corrosione della cella a concentrazione di ossigeno.
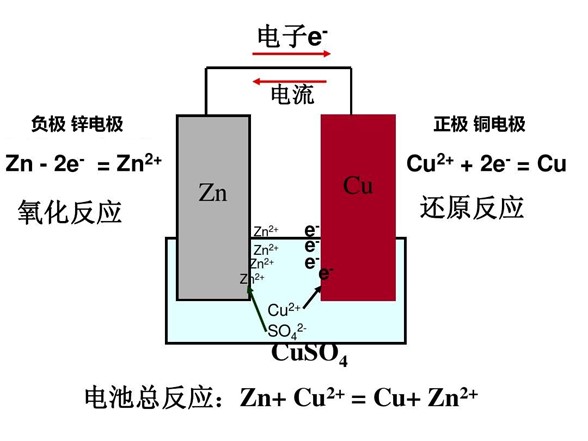
3.4 Corrosione galvanica
Quando metalli diversi sono immersi nello stesso liquido, si verifica una reazione elettrochimica che provoca la corrosione galvanica. Questo è il principio alla base delle batterie.
Principio della batteria
3.5 Corrosione Corrosione
La corrosione per erosione si verifica quando i liquidi a scorrimento veloce asportano meccanicamente la superficie metallica. Questo fenomeno è particolarmente importante nelle tubazioni e nei sistemi di pompaggio.
3.6 Corrosione da fretting
Simile all'erosione, la corrosione da sfregamento si verifica quando i materiali solidi rimuovono le pellicole protettive dalle superfici metalliche, come accade comunemente nei punti di contatto tra le parti.
3.7 Corrosione da vaiolatura
La corrosione per vaiolatura si verifica quando piccole aree di una superficie metallica subiscono una corrosione localizzata. Ad esempio, quando uno strato di ossido protettivo viene graffiato, l'area esposta diventa un anodo, dando origine a un pozzo di corrosione.
3.8 Corrosione intergranulare
La corrosione intergranulare è un tipo di corrosione localizzata che si diffonde lungo i confini dei grani dei metalli. Si verifica negli acciai inossidabili quando vengono riscaldati a determinate temperature, creando zone impoverite di cromo ai confini dei grani, con conseguente perdita di resistenza alla corrosione.
3.9 Corrosione da stress
La corrosione da stress si verifica in presenza di sollecitazioni di trazione, soprattutto nei pezzi saldati con tensioni residue. La pellicola protettiva sulla superficie del metallo si danneggia, dando origine a cricche che si propagano nel tempo, causando fratture.
3.10 Corrosione microbica indotta
I microrganismi, come i batteri aerobici e anaerobici, presenti nei fluidi per la lavorazione dei metalli a base d'acqua possono causare la corrosione indotta dai microbi. I batteri aerobici degradano le molecole a catena lunga dei lubrificanti, formando acidi che causano la corrosione, mentre i batteri anaerobici producono composti di zolfo che portano alla decolorazione.
Respirazione batterica

4. Contromisure per la prevenzione della corrosione
- Agenti passivanti
I metalli possono formare uno strato di ossido naturale per la passivazione, oppure possono essere utilizzati sali specifici per creare una pellicola protettiva sulla superficie del metallo. Ad esempio, il ferro può essere passivato mediante immersione in nitriti, cromati o molibdati.
- Pellicole organiche
Le pellicole organiche, come i rivestimenti a base di olio, possono essere applicate alle superfici metalliche, formando una barriera tra il metallo e l'ambiente circostante. Tuttavia, questo metodo fornisce solo una protezione temporanea.
- Inibitori batterici
Se la corrosione è causata da batteri, si possono usare battericidi per inibire i batteri aerobici, mentre si può aggiungere ossigeno per controllare i batteri anaerobici. Se la corrosione microbica è già estesa, potrebbe essere necessario sostituire il fluido di lavoro per evitare ulteriori danni.

