A corrosão metálica refere-se à degradação dos materiais causada pela reação entre o metal e o seu ambiente. Trata-se de um processo eletroquímico, em que qualquer condição que facilite o fluxo de electrões acelera a corrosão.
1. tipos de corrosão metálica
Dependendo do ambiente de corrosão e do tipo de metal, a corrosão pode ser classificada em três formas: descoloração, corrosão e ferrugem.
- Descoloração
A descoloração é uma forma ligeira de corrosão da superfície que resulta em alterações de cor ou perda de brilho. Geralmente não afecta a integridade estrutural do metal, mas apenas a sua aparência. Metais como o cobre e a prata podem descolorir em ambientes com oxigénio, enxofre ou halogéneos, formando óxidos ou sulfuretos, especialmente em condições de humidade.
- Corrosão
A corrosão envolve danos mais extensos e alterações nas propriedades metalúrgicas. Por exemplo, quando o alumínio ou o zinco se corroem, formam um pó branco, e o cobre forma uma camada verde.
- Ferrugem
A ferrugem é a corrosão de metais ferrosos como o ferro, resultando na formação de óxidos de ferro, que é o tipo mais comum de corrosão.
2. mecanismo de corrosão de metais comuns
A essência da corrosão é a troca de electrões entre a superfície do metal e o seu ambiente. Neste processo, o metal é oxidado, dando origem a reacções electroquímicas. Por exemplo, na corrosão do ferro com gotículas de água, forma-se uma célula de concentração que provoca a corrosão. O teor de oxigénio no centro da gota de água é menor do que nas extremidades, criando uma região anódica e catódica, levando à formação de ferrugem.
Mecanismo de formação de ferrugem na superfície do ferro
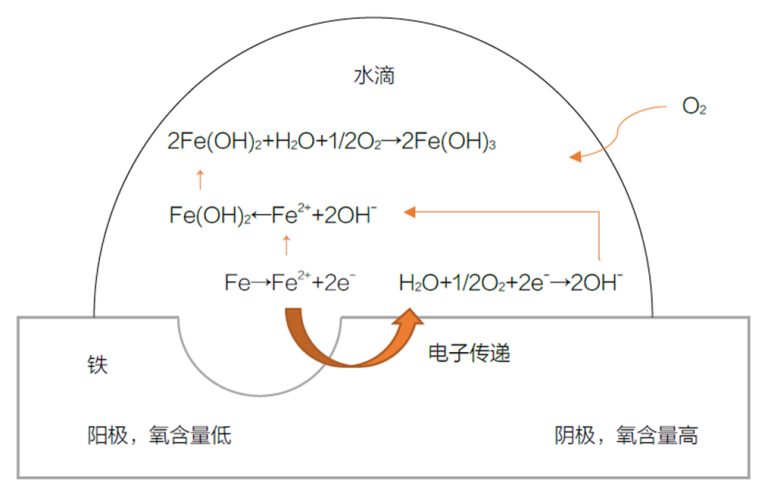
- A região de baixo oxigénio actua como ânodo, onde os átomos de ferro perdem electrões e se transformam em iões de ferro: Fe → Fe²⁺ + 2e-
- Na extremidade da gota de água, a água e os electrões libertados reduzem o oxigénio, formando iões hidróxido (região catódica): ½ O₂ + H₂O + 2e- → 2OH-
- Os iões hidróxido combinam-se com os iões ferro para formar hidróxido ferroso: Fe²⁺ + 2OH- → Fe(OH)₂
- O hidróxido ferroso reage ainda com água e oxigénio, formando ferrugem castanha: 2Fe(OH)₂ + H₂O + ½ O₂ → 2Fe(OH)₃
3. tipos de corrosão
3.1 Corrosão uniforme
Quando a água ou outros líquidos cobrem totalmente uma superfície metálica, as regiões anódicas e catódicas deslocam-se continuamente, conduzindo a uma corrosão uniforme. Esta é a forma mais comum de corrosão metálica quotidiana.
3.2 Efeitos dos electrólitos
A água pura tem um baixo potencial de corrosão devido à sua baixa capacidade de ionização. No entanto, a adição de ácidos, bases ou sais aumenta a concentração de iões, acelerando a corrosão. Em alguns casos, os electrólitos reagem com a superfície do metal para formar uma película de passivação, abrandando o processo de corrosão.
3.3 Corrosão por concentração de oxigénio
Como descrito anteriormente, a região de baixo oxigénio actua como ânodo e a região de alto oxigénio actua como cátodo, causando a corrosão da célula de concentração de oxigénio.
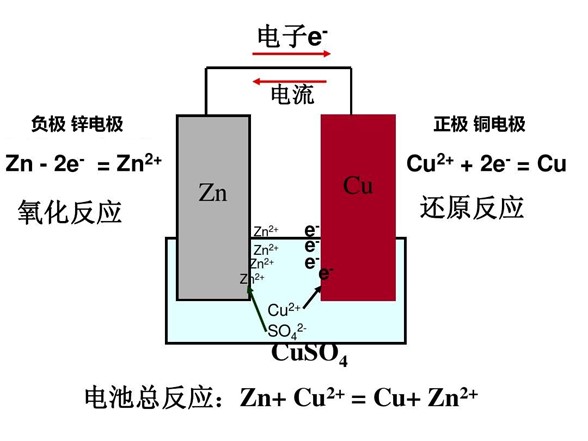
3.4 Corrosão galvânica
Quando metais diferentes são imersos no mesmo líquido, ocorre uma reação eletroquímica que provoca a corrosão galvânica. Este é o princípio subjacente às pilhas.
Princípio da bateria
3.5 Erosão Corrosão
A corrosão por erosão ocorre quando os líquidos de fluxo rápido removem mecanicamente a superfície do metal. Isto é particularmente importante em tubagens e sistemas de bombas.
3.6 Corrosão por atrito
Semelhante à erosão, a corrosão por atrito ocorre quando os materiais sólidos removem as películas protectoras das superfícies metálicas, normalmente observadas em pontos de contacto entre peças.
3.7 Corrosão por pite
A corrosão por pite ocorre quando pequenas áreas de uma superfície metálica sofrem corrosão localizada. Por exemplo, quando uma camada protetora de óxido é riscada, a área exposta torna-se um ânodo, dando origem a um poço de corrosão.
3.8 Corrosão intergranular
A corrosão intergranular é um tipo de corrosão localizada que se propaga ao longo dos limites de grão dos metais. Ocorre no aço inoxidável quando aquecido a determinadas temperaturas, criando zonas empobrecidas em crómio nos limites dos grãos, o que leva à perda de resistência à corrosão.
3.9 Corrosão sob tensão
A corrosão por tensão ocorre sob tensão de tração, especialmente em peças soldadas com tensão residual. A película protetora da superfície metálica é danificada, dando origem a fissuras que se propagam ao longo do tempo, causando fracturas.
3.10 Corrosão microbiana induzida
Os microrganismos, como as bactérias aeróbias e anaeróbias, nos fluidos metalúrgicos à base de água podem causar corrosão induzida por micróbios. As bactérias aeróbias degradam moléculas de cadeia longa em lubrificantes, formando ácidos que causam corrosão, enquanto as bactérias anaeróbias produzem compostos de enxofre, levando à descoloração.
Respiração bacteriana

4. contramedidas de prevenção da corrosão
- Agentes de passivação
Os metais podem formar uma camada de óxido natural para passivação, ou podem ser utilizados sais específicos para criar uma película protetora na superfície do metal. Por exemplo, o ferro pode ser passivado por imersão em nitritos, cromatos ou molibdatos.
- Filmes orgânicos
As películas orgânicas, como os revestimentos à base de óleo, podem ser aplicadas em superfícies metálicas, formando uma barreira entre o metal e o seu ambiente. No entanto, este método apenas proporciona uma proteção temporária.
- Inibidores bacterianos
Se a corrosão for causada por bactérias, podem ser utilizados bactericidas para inibir as bactérias aeróbias, enquanto o oxigénio pode ser adicionado para controlar as bactérias anaeróbias. Se a corrosão microbiana já for extensa, o fluido de trabalho poderá ter de ser substituído para evitar mais danos.

