Коррозия металла - это разрушение материалов, вызванное реакцией между металлом и окружающей средой. Это электрохимический процесс, при котором любые условия, способствующие потоку электронов, ускоряют коррозию.
1.Виды коррозии металлов
В зависимости от коррозионной среды и типа металла коррозия может быть классифицирована на три формы: обесцвечивание, коррозия и ржавчина.
- Обесцвечивание
Обесцвечивание - это легкая форма поверхностной коррозии, которая приводит к изменению цвета или потере блеска. Как правило, оно не влияет на структурную целостность металла, а только на его внешний вид. Такие металлы, как медь и серебро, могут обесцвечиваться в среде с кислородом, серой или галогенами, образуя оксиды или сульфиды, особенно в условиях повышенной влажности.
- Коррозия
Коррозия предполагает более обширные повреждения и изменение металлургических свойств. Например, при коррозии алюминия или цинка образуется белый порошок, а меди - зеленый слой.
- Ржавчина
Ржавчина - это коррозия черных металлов, таких как железо, приводящая к образованию оксидов железа, что является наиболее распространенным видом коррозии.
2.Механизм коррозии обычных металлов
Суть коррозии заключается в обмене электронами между поверхностью металла и окружающей средой. При этом металл окисляется, что приводит к электрохимическим реакциям. Например, при коррозии железа с капельками воды образуется концентрационная ячейка, вызывающая коррозию. Содержание кислорода в центре капли воды ниже, чем по краям, что создает анодную и катодную области, приводящие к образованию ржавчины.
Механизм образования ржавчины на поверхности железа
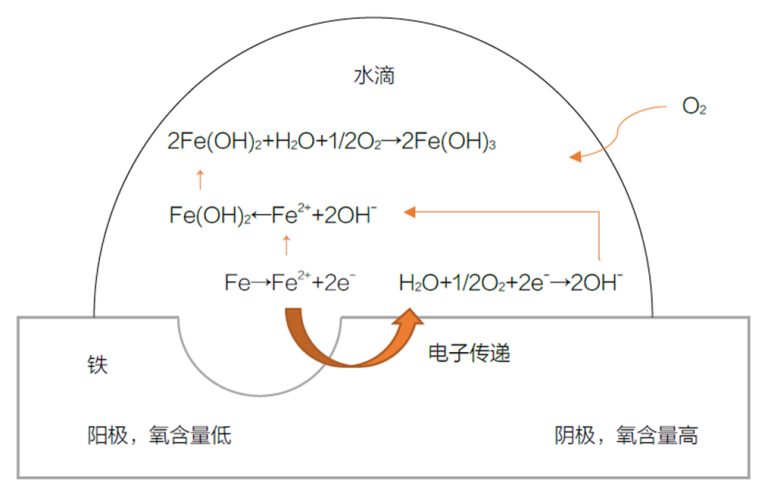
- Область с низким содержанием кислорода выступает в качестве анода, где атомы железа теряют электроны и превращаются в ионы железа: Fe → Fe²⁺ + 2e-
- На краю капли воды вода и освободившиеся электроны восстанавливают кислород, образуя гидроксид-ионы (область катода): ½ O₂ + H₂O + 2e- → 2OH-
- Гидроксид-ионы соединяются с ионами железа, образуя гидроксид железа: Fe²⁺ + 2OH- → Fe(OH)₂.
- Далее гидроксид железа вступает в реакцию с водой и кислородом, образуя коричневую ржавчину: 2Fe(OH)₂ + H₂O + ½ O₂ → 2Fe(OH)₃.
3.Виды коррозии
3.1 Равномерная коррозия
Когда вода или другая жидкость полностью покрывает металлическую поверхность, области анода и катода постоянно смещаются, что приводит к равномерной коррозии. Это наиболее распространенная форма повседневной коррозии металлов.
3.2 Влияние электролитов
Чистая вода обладает низким потенциалом коррозии из-за низкой способности к ионизации. Однако добавление кислот, оснований или солей увеличивает концентрацию ионов, ускоряя коррозию. В некоторых случаях электролиты вступают в реакцию с поверхностью металла, образуя пассивирующую пленку, замедляющую процесс коррозии.
3.3 Коррозия под действием концентрации кислорода
Как было описано ранее, область с низким содержанием кислорода действует как анод, а область с высоким содержанием кислорода действует как катод, вызывая коррозию ячейки с концентрацией кислорода.
3.4 Гальваническая коррозия
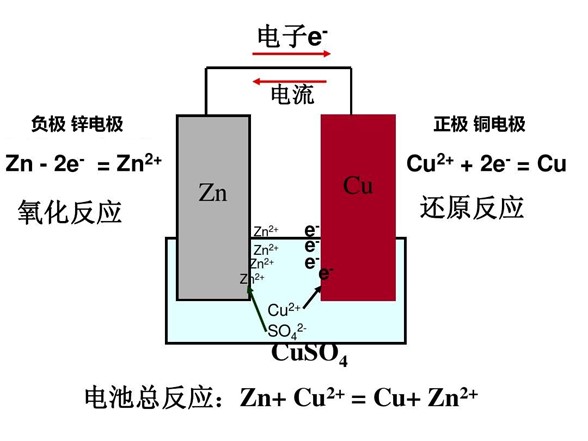
Когда разные металлы погружаются в одну и ту же жидкость, происходит электрохимическая реакция, вызывающая гальваническую коррозию. По такому принципу работают аккумуляторы.
Принцип работы аккумулятора
3.5 Эрозия Коррозия
Эрозионная коррозия возникает, когда быстро текущие жидкости механически удаляют металлическую поверхность. Это особенно важно для трубопроводов и насосных систем.
3.6 Фреттинг-коррозия
Подобно эрозии, фреттинг-коррозия возникает, когда твердые материалы удаляют защитные пленки с металлических поверхностей, что обычно наблюдается в местах контакта между деталями.
3.7 Питтинговая коррозия
Точечная коррозия возникает, когда небольшие участки металлической поверхности подвергаются локальной коррозии. Например, когда защитный оксидный слой царапается, открытая область становится анодом, что приводит к образованию коррозионной ямы.
3.8 Межкристаллитная коррозия
Межкристаллитная коррозия - это тип локализованной коррозии, распространяющейся по границам зерен металлов. Она возникает в нержавеющей стали при нагреве до определенных температур, образуя зоны с пониженным содержанием хрома на границах зерен, что приводит к потере коррозионной стойкости.
3.9 Коррозия под напряжением
Коррозия под напряжением возникает при растяжении, особенно в сварных деталях с остаточным напряжением. Защитная пленка на поверхности металла повреждается, что приводит к образованию трещин, которые со временем распространяются, вызывая разрушения.
3.10 Коррозия, вызванная микроорганизмами
Микроорганизмы, такие как аэробные и анаэробные бактерии, содержащиеся в водных жидкостях для металлообработки, могут вызывать коррозию, вызванную микроорганизмами. Аэробные бактерии разрушают длинноцепочечные молекулы в смазочных материалах, образуя кислоты, вызывающие коррозию, а анаэробные бактерии производят соединения серы, приводящие к обесцвечиванию.
Бактериальное дыхание

4.Меры по предотвращению коррозии
- Пассивирующие агенты
Металлы могут образовывать естественный оксидный слой для пассивации, или же для создания защитной пленки на поверхности металла можно использовать специальные соли. Например, железо можно пассивировать погружением в нитриты, хроматы или молибдаты.
- Органические пленки
Органические пленки, например, покрытия на масляной основе, могут наноситься на металлические поверхности, образуя барьер между металлом и окружающей средой. Однако этот метод обеспечивает лишь временную защиту.
- Ингибиторы бактерий
Если коррозия вызвана бактериями, для подавления аэробных бактерий можно использовать бактерициды, а для борьбы с анаэробными бактериями можно добавить кислород. Если микробная коррозия уже обширна, может потребоваться замена рабочей жидкости для предотвращения дальнейшего повреждения.

